3.EFFET PHYSIOLOGIQUE DU DÉRIVÉ D’ARABINOXYLANE DE SON DE RIZ (Biobran)
3.1 ImmunoRÉGULATION
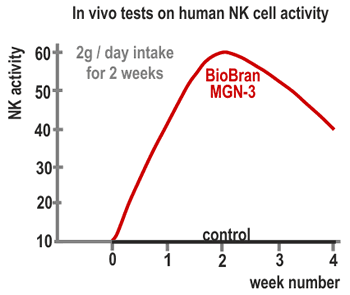
(a) Augmentation de l’activité des cellules NK humaines à l’aide de l’arabinoxylane modifié
de son de riz (Biobran MGN-3)
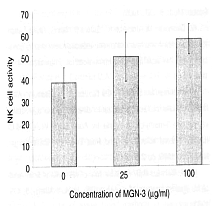
1. 1. Test in vitro
Des cellules NK de rat ont été mises en incubation avec des cellules-cibles cancéreuses
K-562 en présence de Biobran MGN-3 ; la quantité de cellules K-562 a été ensuite mesurée au
moyen du test au 51Cr-EDTA. Une élévation de la concentration de cellules décomposées a été
constatée proportionnellement la concentration de Biobran MGN-3 (de 25 µg/mlet de 100 µg/ml)
utilisée, ceci confirmant que l’augmentation de l’activité des cellules NK a été provoquée
par l’effet du produit Biobran MGN-3.
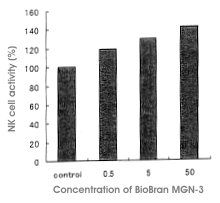
2. Test in vivo (sur rats)
Du Biobran MGN-3 a été administré à des rats Sprague-Dawley et l’activité des cellules NK
a été mesurée deux semaines après. Les rats ont été répartis en trois groupes de 5
individus, à chaque groupe correspondait une dose du produit de concentration respective 0,5
mg, 5 mg, et 50 mg/kg/par jour. L’activité des cellules NK a enregistré des variations en
fonction de la concentration de la dose de Biobran MGN-3administrée. Par rapport au groupe
de contrôle, les groupes ayant reçu des doses de 0,5 mg, 5 mg et 5 mg ont fait apparaître
une augmentation de l’activité des cellules tueuses, à savoir respectivement de 119 %, 130 %
et 142 %. Dans le groupe ayant reçu une dose de 50 mg, l’activité des cellules tueuses
a monté à 132 % par rapport au groupe de contrôle déjà trois jours après le début de
l’administration du produit. La croissance de l’activité des cellules NK causée par le
Biobran MGN-3 peut être portée au compte de la force destructrice des cellules NK, mais
a dépendu en même temps aussi du nombre total de cellules NK. On a observé une différence
d’effet entre les mâles et les femelles, celui-ci étant plus important chez les femelles
(Fig. 3).
3. Effet sur les hommes
Dans le cadre des essais des effets du Biobran MGN-3 sur les hommes, 24 individus en bonne
santé (15 femmes et 9 hommes d’une moyenne d’âge de 34 ans) ont pris le produit sur une
durée ininterrompue de 60 jours puis on a observé chez eux l’activité des cellules NK. Les
participants à l’expérience ont été répartis en 3 groupes de 8 personnes prenant des doses
journalières de 15 mg/kg, de 30 mg/kg, et de 45 mg/kg de masse corporelle. Un prélèvement de
sang (20 ml) a été effectué sur chacun des participants avant la prise du produit, une
semaine après le début de la prise du produit, un mois après, deux mois après (à l’issue de
la prise du produit) et un mois après la fin de la prise du produit pour mesurer l’activité
des cellules NK. Chez les groupes ayant pris les doses de 30 mg et de 45 mg, l’activité des
cellules NK a augmentédu double au bout d’une semaine d’utilisation du produit, et du triple
deux mois après. Dans le groupe ayant pris la dose de 15 mg, l’activité a rapidement
augmenté au bout d’un mois d’utilisation et a atteint, après deux mois, presque le même
niveau que dans les groupes aux doses de 30 mg et de 45 mg. Un mois après la fin de la prise
du produit, l’activité des cellules NK est revenue au niveau d’avant le début des essais
(Fig. 4). Ces résultats indiquent que la prise quotidienne d’une dose de 15 – 45 mg/kg de
produit Biobran MGN-3 a un réel impact sur l’activité des cellules NK humaines.
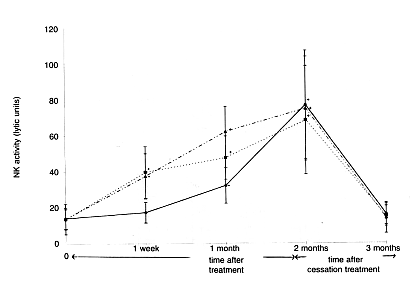
<Fig 4: Activation des cellules NK par le Biobran MGN-3en fonction du
temps et de la dose en présence de cellules cancéreuses K562
…_.._.._.._ = 45mg/kg par jour;
…………=30mg/kg par jour;
_______=15mg/kg par jour
4. 4. Mécanisme de l’effet du produit Biobran MGN-3 sur les cellules NK
Les deux expériences in vitro et in vivo ont confirmé que la quantité des granules
cytotoxiques dans les cellules NK stimulées par le Biobran MGN-3 augmentaient. On a aussi
examiné la capacité de ces cellules de se lier aux cellules-cibles. Dans le test, les
cellules NK de l’individu qui prenait une dose quotidienne de 45 mg/kg de Biobran MGN-3
pendant 30 jours ont été mises en incubation avec des cellules-cibles K-562, puis leur
capacité de se lier aux cellules-cibles a été mesurée. Au bout d’une heure d’incubation
commune à une température de 4°C, on a mesuré 200 cellules NK et on a calculé le taux de
création de liaisons avec les cellules K-562. Après la prise de Biobran MGN-3, on a constaté
chez l’individu un taux de création de liaisons des cellules NK avec les cellules-cibles
(K-562) bien plus élevé qu’avant l’utilisation du produit, et ce de 38,5 % contre 9,4 %. La
figure 6 représente une photographie de ces liaisons.
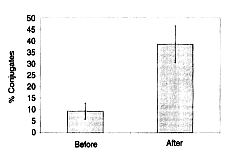 Figure 5: Taux de formation des liaisons entre les cellules naturelles
tueuses (cellules NK) et les cellules-cibles K562. Légende : % de liaisons>Avant
utilisation>Après utilisation
Figure 5: Taux de formation des liaisons entre les cellules naturelles
tueuses (cellules NK) et les cellules-cibles K562. Légende : % de liaisons>Avant
utilisation>Après utilisation
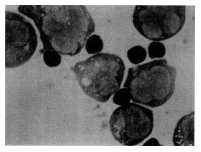 Fig 6: Formations mortelles de cellules NK et de cellules–cibles
cancéreuses.
Fig 6: Formations mortelles de cellules NK et de cellules–cibles
cancéreuses.
Ghoneum M. (Université Ch. R. Drew,Etats-Unis):INT. IMMUNO THERAPY XIV (2) p.89-99, 1998
(b) Effet in vitro du produit Biobran MGN-3 sur l’activité des cellules du groupe de
macrophages
L’effet du Biobran MGN-3 sur les cellules du groupe de macrophages, sur l’induction de la
production de médiateurs pharmacologiques, concrètement de TNF-a, IL-6 et NO, a été examiné.
Les macrophages ont été mis en incubation avec le Biobran MGN-3 sous différentes
concentrations (de 1 à 100 µg/ml) et les surnageants ont été ensuite testés à la présence
des médiateurs mentionnés. Le TNF-a a été analysé d’après sa toxicité envers le L929, l’IL-6
d’après la cytose B13.19 et le NO colorimétriquement d’après la réaction au réactif
de Griess. On a utilisé le lipopolysaccharide (LPS) comme contrôle positif.
- En utilisant la lignée cellulaire de macrophages RAW264.7 de souris, le Biobran MGN-3
a montré un effet important sur les trois médiateurs indiqués dès les concentrations
supérieures à 10 µg/ml, comme le LPS.
- Utilisation des macrophages péritonéaux de souris (C3H/He) : l’effet du Biobran
MGN-3 sur la sécrétion de macrophages de la cavité péritonéale chez la souris normale
est indiqué sur la Fig. 7. Le Biobran MGN-3 a de nouveau montré la force de son effet
dans le cas de concentrations supérieures à 10 µg/ml.
- Lignée cellulaire des macrophages humains U937 :le MGN-3 a induit une forte
activité que confirment les niveaux enregistrés de cytokines TNF-a et IL-6 produits qui
étaient équivalents à celui de LPS à savoir 100 µg/ml.
Les résultats montrent que le Biobran MGN-3 possède un fort potentiel d’activation des
macrophages normaux des souris et des hommes. Il découle de cette étude que les
concentrations sont actives quand supérieures à 10 µg/ml.
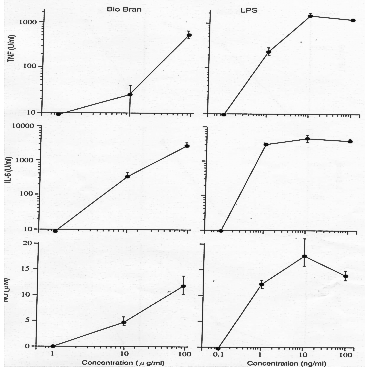 Figure 7: Matsuura M. (École de Médecine de Djitshi, JAPON) : Rapport de
l’École de Médecine de Djitshi
Figure 7: Matsuura M. (École de Médecine de Djitshi, JAPON) : Rapport de
l’École de Médecine de Djitshi
(c) Immunostimulation et prévention du cancer
De nombreuses études ont démontré qu’il existaitun risque accru de cancer chez les personnes
exposées à l’influence de divers produits chimiquessur leur lieu de travail. L’une de ces
études s’est donné pour objectif d’examiner le changement de l’immunité dans le cas de
l’influence de produits chimiques et comment l’organisme peut mieux réagir à la toxicité
chimique à l’aide du produit Biobran MGN-3.
Ont participé à cette étude onze personnes soumises à l’infuence de produits chimiques au
travail. Celles-ci souffraient de dysfonctionnement du système immunitaire qui se
manifestait par de bas niveaux d’activité des cellules NK (10,2±4,2unités lytiques), par une
réponse blastogène des lymphocytes aux mitogènes des cellules T (PHA, 39060±12517cpm a COMA,
36224±11922cpm) et aux mitogènes des cellules B (PWM, 16550±6330cpm) par rapport aux
réponses dansle groupe de contrôle. Une dose quotidienne de 15mg/kg de Biobran MGN-3 était
donnée aux participants à l’étude sur une période de quatre mois. Le traitement au Biobran
a multiplié par 4 l’activité des cellules NK au bout de deux mois, et multiplié par 7 au
bout de quatre mois, etle fonctionnement des cellulesT et B a augmenté de 130, voire 150 %
par rapport aux valeurs d’origine.
Ghoneum M. (Université Ch. R. Drew, États-Unis) : Résumé du Recueil de conférence du 7e
Congrès international des Technologies biomédicales orientées contre le vieillissement,
1999
(d) Production stimulée de TNF-α et IF-γ dans les lymphocytes de sang périphérique humain
par l’intermédiaire de l’arabinoxylane modifié de son de riz contenu dans le Biobran
MGN-3.
On a étudié le mécanisme par lequel le Biobran MGN-3 augmente l’activité cytotoxique des
cellules NK. L’effet du produit a été testé sur l’intensité de sécrétion du facteur -α,
(TNF-α) et de l’interféron-γ (IFN-γ) provoquant la nécrose tumorale ainsi que sur
l’expression des récepteurs-clés à la surface des cellules.
Les lymphocytes du sang périphérique ont été mis en incubation avec le produit Biobran MGN-3
de concentrations 0,1 et 1 mg/ml et les solutions ont été soumises au test ELISA. Les
résultats ont montré que le Biobran MGN-3 est un inducteur potentiel de TNF-α, l’effet
variant selon le dosage. Les concentrations de Biobran MGN-3 de0,1 et 1 mg/ml ont mutiplié
la production de TNF-α respectivement de 22,8 et 47,1 fois. Le Biobran MGN-3 a augmenté
également la production de IFN-γ, même si cette augmentation a été inférieure à celle
enregistrée du TNF-α. En ce qui concerne les récepteurs-clés de la surface des cellules, le
Biobran MGN-3 a accru l’expression de l’antigène d’activation précoceCD69au bout de 16
heures d‘incubation. Par ailleurs, à l’issue de l’incubation avec le Biobran MGN-3, on
a observé une régulation positive du récepteur d’interleukine-2, de la molécule CD25 et de
la molécule d’adhésion intercellulaire ICAM-1 (CD54). L’incubation des cellules NK hautement
purifiées avec leMGN-3,également, a eu pour conséquence une augmentation des niveaux de
sécrétion du TNF-α et de l’IFN-γ combiné avec l’amélioration du fonctionnement cytotoxique
des cellules NK. De plus, l’addition du Biobran MGN-3 aux cellules NK activées par
l’interleukine-2 a eu pour conséquence une induction synergique de la sécrétion de TNF-α et
de IFN-γ.
Ghoneum M. (Université Ch. R. Drew, États-Unis), Jewett A. (UCLA, États-Unis) : Cancer
Detection and Prevention (Détection et prévention du cancer) Tôme 24/Numéro 4, 2000
(e) Effet de l’arabinoxylane modifié de son de riz sur l’activité des cellules NK des
lymphocytes humains de sang périphérique
Les effets du produit Biobran MGN-3 et de ses fractions moléculaires sur l’activité des
cellules NK ont été examinés. Des fractions de haut poids moléculaire (10 – 50 kDa) obtenues
par filtration sur gel au Sephadex G-25 et G-75 ont été ajoutées aux lymphocytes humains de
sang périphérique. L’activité des cellules NK a été mesurée après 3 jours d’incubation. Des
cellules marquées fluorescentes de la lignée cellulaire K-562 ont été utilisées comme
cellules-cibles et l’activité des cellules NK a été établie par la méthode fluorescente Tere
Scan. Une expérience identique a été réalisée en présence d’IL-2.
Les essais n’ont pas détecté de différences essentielles dans l’activation des cellules NK,
que ce soit avec le produit Biobran MGN-3 ou avec ses fractions de poids moléculaire plus
élevé. En revanche, comparativement à la solution où il n’y avait que de l’IL-2, on
a observé une augmentation de l’activité des cellules NK dans les solutions où on avait
ajouté, outre l’interleukine-2, également du Biobran MGN-3 ou de ses fractions. Ceci indique
que le Biobran MGN-3 active les cellules NK en présence de l’IL-2 et qu’une telle activité
se produit également en présence deses fractions de poids moléculaire plus élevé.
Ueda Y., Shimomura C. (Université de Chiba, JAPON) : Résumé de la rencontre annuelle de la
Société japonaise pour les biosciences, les biotechnologies et l’agrochimie 2002
3.2. Effets antiviraux
Effets antiviraux du Biobran MGN-3 contre les VIH in vitro
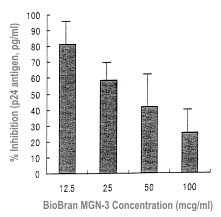
On a d’abord évalué l’effet antiviral du produit Biobran MGN-3 contre la production de
l’antigène p24 du VIH-1 in vitro. Les cellules mononucléaires obtenues auprès de trois
individus en bonne santé ont été incubées avec une souche SF de VIH-1 à température de 37°C
pendant une heure en présence du Biobran MGN-3 aux concentrations allant de 0 à 100 µg/ml.
En fonction de la concentration, le Biobran MGN-3 a inhibé la création des formations
syncytiales, sachant que le taux maximal de cette inhibition était de 75 % à la
concentration de 100/ml) (Tableau n° 1).
 |
|
Tableau n° 1
| Inhibition par le produit Biobran des formations
syncytiales
|
| Dose de Biobran(μg/ml) |
Formations syncytiales(SF) |
| Nombre de SF |
% d’inhibition |
0
12.5
25
50
100
|
42.0±8
25.8±7
21.5±5
15.8±4
10.5±3
|
00.0
38.5
50.0
62.5
75.0
|
|
| Fig. 8 Légende : % d’inhibition (antigène p24, pg/ml) >Concentration du produit BioBran MGN-3 (µg/ml)
|
|
|
Ghoneum M. (Université Ch. R. Drew, États-Unis):Biochemical and Biophysical Research
Communications (Communications de la recherche biophysique et biochimique) 243, (1998)
3.3. Effet anticancéreux
(a) Étude de l’effet des composantes de l’arabinoxylane modifié de son de riz sur
l’inhibition de la croissance des cellules cancéreuses de lignées différentes
Dans cette étude, on a examiné l’effet de l’arabinoxylane modifié de son de riz contenu dans
le Biobran MGN-3 sur les cellules cancéreuses de lignées différentes telles que HL60, K562
et HLE ainsi que sur l’induction potentielle de la différenciation des lignées HL60 et
K562.Du Biobran MGN-3 a été ajouté à la culture de lignées cellulaires. Au bout de 3 jours
d’incubation, le nombre des cellules survivantes sur toutes les lignées a diminué
proportionnellement à la quantité de produit Biobran MGN-3.
Après précipitation à l’éthanol le précipité a été mélangé à de l’eau distillée, le
supernageant ainsi obenu a été fractionné à l’aide de la colonne Sephadex G-25 en 3
fractions (A, B, C) et celles-ci ont été ajoutées aux cultures de lignées cellulaires. Des
effets d’inhibition sur la croissance ont été observés, sur la fraction C, les lignes HL60
et K562 ainsi que sur les fractions B et C, et la lignée HLE. De plus, la coloration au
Giemsa et l’estérase non spécifique ont fait apparaître une induction potentielle de
différenciation sur les lignées HL60 et K562. Ces résultats indiquent que le Biobran MGN-3
contient des composantes qui montrent une inhibition de la croissance des cellules
cancéreuses et une induction potentielle de la différenciation des lignées HL60 et K562.
Masada M. (Université de Chiba, JAPON) : Résumé de la rencontre annuelle de la Société
japonaise pour les biosciences, les biotechnologies et l’agrochimie 2002
(b) Influence du produit Biobran MGN-3 sur la croissance des cellules cancéreuses
On a examiné l’influence directe du Biobran MGN-3 sur la croissance des cellules cancéreuses
de la peau et la production de cytokine. En comparaison avec le groupe de contrôle des
cellules du carcinome squameux de la lignée cellulaire SCC13 cultivée dans du médium MEM où
la croissance des cellules a continué, l’incubation des cellules de cette lignée [SCC13]
avec du Biobran MGN-3 a stoppé la croissance des cellules cancéreuses (on a observé 30 % de
cellules en moins au bout de 48 heures et 50 % de moins après 72 heures de cultivation par
rapport à la culture de contrôle indiquée).
Les analyses réalisées par cytométrie en flux ont montré qu’après 16 heures d’incubation des
cellules SCC13 avec du Biobran MGN-3, une multiplication par cinq des niveaux
intracellulaires de l’interleukine 10 [IL-10] a eu lieu sans qu’il y ait eu de modification
évidente du contenu de l’interféron-γ [INF-γ]. Les tests ELISA du médium de culture avec les
cellules SCC13 ont montré des niveaux 8 fois supérieurs d’IL-10 et 3 fois supérieurs
d’IL-12. On n’a enregistré qu’un petit changement au niveau de la concentration d’INF-γ. En
outre, on a évalué également l’influence du produit Biobran MGN-3 sur d’autres lignées
cellulaires telles que des cellules normales et cancéreuses du sein et des cellules
cancéreuses de la prostate.
Ces observatioons indiquent que le Biobran MGN-3 agit non seulement par une amélioration de
l’immunité de l’organisme hôte mais aussi par une influence directe sur la croissance des
cellules cancéreuses et la production des cytokines. En même temps, il se peut que derrrière
ces observations se cache un mécanisme jusque-là inconnu d’effet qui expliquerait le succès
clinique remarquable et l’apport imposant du traitement au Biobran MGN-3 noté par l’auteur
au cours des 4 dernières années.
Ghoneum M. (Université Ch. R. Drew, États-Unis) : Résumé du Recueil de conférence du 8e
Congrès international sur les Technologies biomédicales orientées contre le vieillissement,
2000
3.4. Effet complémentaire lors du traitement du cancer
(a) L’évaluation de la dépendance de l’activité des cellules NK et du taux de survie des
patients souffrant de différents types de cancers en présence de l’application de protocoles
de thérapie multi-immunologiques
L’étude présente s’est fixé pour but d’établir si l’administration du produit Biobran MGN-3
a pu avoir pour effet une prolongation de la survie et une amélioration de la qualité de vie
pendant la période de survie, et ce sur un échantillon de 205 patients souffrant de cancers
en IIe et IVe stades de maladie, après intervention chirurgicale. Des patients hospitalisés
à la clinique de chirurgie Sano au Japon ont participé à cette étude. Ils ont été soignés au
moyen de médicaments alternatifs complémentaires et de médicaments anticancéreux
conventionnels aux faibles effets indésirables.
Les 205 patients hospitalisés pendant 6 mois ont été divisés en deux groupes : 109 patients
du groupe témoin ont été soignés par une thérapie alternative complémentaire standard tandis
qu’on a ajouté du Biobran MGN-3 à celle des autres 96 patients sur une durée d’un an et
demi.
Chez tous les patients on a mesuré l’activité des cellules NK pour voir la variation des
paramètres immunitaires. Parallèlement on a procédé au contrôle de la qualité de survie chez
tous les patients. L’activité des cellules NK était assez basse chez les patients ayant subi
une intervention chirurgicale, par contre, chez les patients auxquels on avait administré le
Biobran MGN-3, on a constaté un taux augmenté d’apotanase (survie plus longue), sachant que
cet effet chez les patients a été d’autant plus élevé que l’était l’activité des cellules NK
elle-même (Tableau n° 2). Ces constatations laissent supposer que le niveau de l’activité
des cellules NK peut être considéré comme un indicateur pathologique dans le cas des types
progressifs de cancer. Chez le groupe de patients auxquels on avait administré du Biobran
MGN-3 une amélioration de la qualité de vie a été également observée.
Tableau n° 2: Relation entre le taux global de survie, l’activité des cellules NK et le taux
de survie dans les 2 groupes suivis
| Groupe |
Groupe Biobran |
Groupe témoin |
| Taux global de survie |
52/96 (54.2%) |
19/63 (33.9%) |
Catégories en fonction de l’activité des celllules NK
inférieure à 19.9%
20%-40%
supérieure à 40%
|
17/40 (42.5%)**
18/35 (51.4%)*
17/21 (81.0%)
|
2/16 (12.5%)
7/25 (28.0%)
10/15 (66.7%)
|
% de l’importance par rapport au groupe témoin **p<0.01 *p<0.05
Takahara K. (Clinique de chirurgie de Sano, JAPON) : Résumé de la 3e rencontre annuelle de
la Société japonaise de traitement et de médecine alternative complémentaire, 2000
(b) Effets immunomodulaires et anticancéreux du Biobran MGN-3 chez 5 patientes atteintes de
cancer du sein
Cinq patientes atteintes de cancer du sein ont absorbé du Biobran MGN-3 à raison de 3 g par
jour puis l’activité des cellules NK sur les cellules-cibles cancéreuses de la lignée K562
a été mesurée par le test 51Cr-EDTA. Les résultats en ont été les suivants:
-
Dans le cas de bas niveaux de l’activité de base des cellules NK (12,7 – 58,3 %)
et de rapports effecteur/cible de 12 et 100:1, lors du traitement au Biobran,
l’activité des cellules NK a augmenté chez les patientes de façon importante (41,8 –
89,5 %) tandis que les rapports effecteur/cible sont restés inchangés.
-
Une activité augmentée des cellules NK a été observée déjà au bout de 1-2
semaines après le début du traitement et a continué de croître avec la poursuite du
traitement au Biobran MGN-3.
-
Deux patientes qui avaient participé à l’étude dès le début (elles se sont soignées
6-8 mois) sont en état de rémission complète.
Ghoneum M. (Université Ch. R. Drew, États-Unis) : Recueil de la conférence extraordinaire de
l’association américaine pour la recherche sur le cancer, 1995
(c) Effet immunomodulaire de l’arabinoxylane modifié de son de riz contenu dans le Biobran
MGN-3 sur les cellules NK d’un groupe de 27 patients oncologiques
On a étudié l’effet immunomodulaire du Biobran MGN-3 chez 27 patients oncologiques. Les
patients souffraient de différents types de malignités de stade avancé : 7 patients avaient
le cancer du sein, 7 le cancer de la prostate, 8 un myélome multiple, 3 la leucémie et 2 le
cancer du col de l’utérus. Tous les patients ont subi un traitement conventionnel qui a été
complété par le produit Biobran MGN-3 d’une dose de 3 g par jour,puis on a examiné
l’activité des cellules NK après 2 semaines, 3 mois et 6 mois. L’activité des celllules NK
a été mesurée par le test 51Cr-EDTA et on a utilisé les cellules tumorales de la lignée K562
comme cellules cibles, avec des rapports effecteur/cible de 12:1 à 100:1. Les résultats ont
donné les indications suivantes
-
L’activité de base des cellules NK enregistrée chez les patients était de bas niveau.
-
Le traitement au Biobran MGN-3 a causé une augmentation importante de l’activité des
cellules NK déjà au bout de 2 semaines. Les taux d’induction de l’activité chez les
différents types de cancer étaient les suivants : cancer du sein 154-332 %, de la
prostate 174-385 %, leucémie 100-240 %, myélome multiple 100-537 % et col de l’utérus
100-275 %.
-
L’activité des cellules NK n’a cessé d’augmenter même après 3 et 6 mois de traitement.
Ghoneum M. (Université Ch. R. Drew, États-Unis): Résumé de la 87e rencontre annuelle de
l’Association américaine de recherche sur le cancer, 1996
(d) Cas de traitement complémentaire du cancer métastatique des poumons à l’aide du Biobran
MGN-3
Ce rapport présente le cas où de bons résultats ont été obtenus après l’application du
complément Biobran MGN-3 chez un patient souffrant de cancer métastatique des poumons
atteignant les os sur une grande étendue.
Le patient était un homme âgé de 67 ans. Il est allé trouver le médecin en août 1996 à cause
d’une baisse brutale de poids et une forte toux grasse. C’est alors qu’on lui adiagnostiqué
un cancer des poumons (carcinome squameux) assorti d’une tuberculose (M. tuberculosis).Après
un traitement à l’antibiotique pour soigner en priorité la tuberculose, le patient a suivi
une série de rayonnements.En décembre de la même année il a subi l’ablation de la moitié
inférieure du poumon droit affecté par la tumeur. Après la radiothérapie le patient a quitté
l’hôpital en janvier 1997.
En juin de cette année-là, le patient revient chez son médecin en se plaignant de douleurs
dans la poitrine côté droit. Une scintigraphie osseuse a confirmé en présence de nombreuses
métastases osseuses. La tumeur s’est étendue principalement dans les côtes du côté droit,
mais le tissu osseux de tout le corps était pratiquement touché. En juillet un traitement
analgésique morphinique en forme retard a été mis en place. Entre temps, fin mai, un
traitement au Biobran MGN-3 a été entamé à raison d’une dose de 3 g par jour. Les douleurs
ont commencé à diminuer à partir de janvier 1998. On a progressivement réduit la dose de
morphine en forme retard jusqu’à l’arrêter complètement pendant l’administration continue du
Biobran MGN-3. Le marqueur tumoral ICPP était de 16,8 ng/ml au moment de la confirmation du
retour de la maladie ; en décembre 1997 il avait baissé progressivement à 7,6 ng/ml puis
jusqu’à 6,7 ng/ml en juin 1998. La scintigraphie osseuse a montré une nette amélioration et
a confirmé que la propagation de la tumeur était en régression. Le niveau de l’activité des
cellules NK, au moment du retour de la maladie, représentait un taux de 9,0 % ; celui-ci a
augmenté petit-à-petit jusqu’à se maintenir actuellement à un haut niveau.
Sobajima T. (HôpitalHoshigaoka Kosei Nenkin, JAPON) : Résumé de la 2e rencontre annuelle de
la Société japonaise pour les traitement et médecine alternatifs et complémentaires, 1999
(e) Application du produit Biobran MGN-3 après traitement conventionnel
Le traitement de tumeur dormante devient au Japon un concept thérapeutique majeur dans
l’approche du cancer. Le but principal d’une telle thérapie est de prolonger la survie du
patient et en même temps d’assurer une haute qualité de vie. Le Dr. Tunekawala prescrit aux
patients qui la souhaitent sachant qu’il considère l’amélioration de la qualité de vie comme
un but thérapeutique important. Dans son rapport, il indique avoir quatre patients atteints
de cancer auxquels il applique une combinaison de chimiothérapie (pour inhiber la tumeur
dormante) et de traitement alternatif et complémentaire, et il décrit le mode thérapeutique
mis en oeuvre chez trois d’entre eux :
-
Patients (maladies principales) : cancer de l’estomac chez 3 d’entre eux, cancer du
poumon chez 3, lymphome malin chez 2, cancer du gros intestin (partie rectale) chez
6, cancer du sein chez 3 et autres types de cancer chez 17
-
Durée de traitement : 6-18 mois
-
Études éventuelles
-
iv. T.S. (60), femme, cancer de l’estomac (stade IV), inflammation carcionomateuse
du bas du péritoine : tumeur squirrheuse de l’estomac opérée en janvier 2000. En
février 2000 gastrectomie suite au développement d’une inflammation carcinomateuse
du péritoine de stade IV. Le CA19-9 était de 108. En août 2000 la patiente se rend à
notre clinique en se plaignant de douleurs dans le ventre, de constipation, d’anémie
et d’anorexie. Le CA19-9 était alors de 390 et l’activité des cellules NK de 25,6.
On lui a prescrit une combinaison de chimiothérapie (TS1) et de traitement
holistique. Pour améliorer son immunité on lui a administré du Biobran MGN-3 à
raison de 3 g par jour. Un mois plus tard la valeur CA19-9 était de 63. Les valeurs
des marqueurs tumoraux ont diminué progressivement et l’activité des cellules NK
a augmenté. En août 2001, 11 mois après, la valeur CA19-9 était de 25 et celle de
l’activité des cellules NK de 51,5. Actuellement la patiente ne fait état de presque
plus aucun symptôme subjectif et elle est bien nourrie.
-
v. F.A. (46), femme, cancer du sein, avec métastases dans les vertèbres lombaires et
l’utérus : la patiente a subi l’ablation du sein en janvier 1998 et un traitement
hormonal et anticancéreux lui a été prescrit. En mars 2001 on lui détecte des
métastases dans les vertèbres lombaires et en avril dans l’utérus, à la suite de
quoi une hysterectomie est effectuée en mai 2001. La patiente quitte l’hôpital avec
un traitement au Taxol et Paraplatine. En juillet 2001 elle vient voir le Dr.
Tunekawa avec des douleurs aux os. La valeur de CA 153, NCC-ST était de 439et celle
de l’activité des cellules NK de 9,3. Elle continue d’être traitée au Paraplatine et
commence une thérapie holistique auquel du Biobran MGN-3 a été ajouté pour améliorer
l’immunité, et ce à raison d’une dose journalière de 3 g. Deux mois plus tard, la
valeur du marqueur CA n’était plus que de 18, celle du NCC-ST de 28,9 et celle de
l’activité des cellules NK de 22,0 et la douleur s’était estompée. Le niveau des
marqueurs tumoraux de la patiente a continué de baisser constamment et celui de
l’activité des cellules NK de monter. En juillet 2002 le niveau de CA était de 14,
celui de NCC-ST de 3,2, celui de l’activité des cellules NK était de 59, la douleur
a disparu complètement et les résultats de la scintigraphie osseuse étaient moins
évidents. À l’heure actuelle, la patiente est bien alimentée et est heureuse de
pouvoir jouer à nouveau aux percussions.
Tunekawa H. (Association Tokai pour la propagation de la médecine holistique, JAPON) :
Résumé du workshop consacré au Biobran, Berlin, 2002
(f) Évaluation de l’effet du produit Biobran MGN-3 dans le traitement du cancer en
progression
Le Dr. Mizukami a exprimenté le traitement au Biobran MGN-3 sur un échantillon de 97
patients atteints du cancer de types différents en stade de progression : cancers de
l’estomac, du gros intestin, du sein, des poumons, du pancréas, du foie, du canal
cholédoque, de l’oesophage, des ovaires, du col de l’utérus, de l’utérus, des reins, de la
glande thyroïde, de la prostate, de la cavité buccale, myélome multiple, etc. Bien que les
patients aient subi des interventions chirurgicales, de la chimiothérapie ou de la
radiothérapie dans de grands hôpitaux, le pronostic de survie de la majorité d’entre eux
était bien mauvais. Ils souffraient de métastases et de récidive et ils se sont donc résolus
à venir à la clinique du Dr. Mizukami et essayer l’immunothérapie. Presque tous les patients
auxquels le Biobran MGN-3 a été administré n’avaient plus de chimiothérapie ni de
radiothérapie à ce moment-là. Après avoir été observés en clinique et avoir répondu à des
questionnaires on a suivi de près leur qualité de survie. Chez tous les patients prenant du
Biobran MGN-3 un phénomène commun a été constaté.
Dans plusieurs cas, la qualité de survie s’est améliorée de manière évidente chez les
patients traités au Biobran MGN-3.Si l’on sait que la qualité de survie des patients
atteints de cancer en stade avancé a tendance généralement à empirer au fur et à mesure que
le temps passe, chez les patients ayant pris le Biobran MGN-3 cette tendance s’est avérée
inverse et s’est même modifiée en survie plus longue et de bonne qualité, et de surcroît on
a enregistré des cas de longue survie.
S’agissant de la qualité de survie, les points suivant sont été observés :
-
Bien que maîtriser de fortes douleurs n’est pas une chose simple et que chez les
patients souffrant de cancer de stade avancé il n’existe pas d’autre solution
souvent que d’avoir recours à la morphine, certains des patients à qui le Biobran
MGN-3 a été administré n’ont plus eu besoin de morphine et d’autres patients qui
continuaient à en prendre ont eu tendance à en faire réduire les doses.
-
Globalement on a noté une tendance plus faible de sentiment de faiblesse.
-
On a observé une tendance moindre à la perte d’appétit.
-
Tendance à pouvoir rester à la maison et se sentir relativement bien avant le
décès.
-
Tendance juste avant la mort à conserver l’esprit clair et la capacité de
communiquer avec la famille.
Le Dr. Mizukami a résumé ses observations en constatant que, pour lespatients souffrant de
cancer de stade avancé, il est établi que la qualité de survie dans le cas de la prise de
Biobran MGN-3 ne s’empire pas de façon aussi brutale, ce qui s’avère être un aspect
important de l’approche du traitement du cancer pour l’avenir.
Mizukami O. (Institut de recherche en soutien à la santé et Fondation laïque New Life,
JAPONSKO) : Résumé du workshop consacré au produit Biobran de Berlin, 2002
3.5. Effet sur l’apoptose
Le Biobran MGN-3 sensibilise les cellules T leucémiques humaines à l’apoptose induite par le
récepteur de mort (CD95)
Dans cette étude on a examiné l’effet du Biobran MGN-3 sur l’apoptose induite par le
récepteur de mort dans les cellules T leucémiques humaines de la lignée HUT 78. Les cellules
HUT 78 ont d’abord été traitées au Biobran MGN-3 puis ont été incubées avec un anticorps
agnostique du récepteur de mort (Fas, CD95). Le taux d’apoptose a été défini par cytométrie
en flux FACScan en utilisant de l’iodure de propidium comme colorant. L’activation de la
caspase 3, de la caspase 8 et de la caspase 9 a été déterminée par cytométrie en flux. Le
potentiel sur la membrane mitochondriale a été mesuré à l’aide du FACScan avec du DIOC6
comme colorant. L’expression du CD95 et du BCI-2 a été mesurée à l’aide de la cytométrie en
flux.
D’après les constatations, et en fonction de ses dosages, le Biobran MGN-3 augmente le taux
d’apoptose induite par l’anti-CD95. Le taux accru de mort des cellules corrèle avec la
croissance de dépolarisation du potentiel sur la membrane mitochondriale ainsi qu’avec
l’activation accrue de caspase 3, caspase 8 et caspase 9. Le traitement au Biobran MGN-3 n’a
pas eu d’impact sur le niveau d’expression du CD95, mais a causé une régulation négative de
l’expression du BCI-2. Les résultats indiquent que le Biobran MGN-3 augmente la
prédisposition du cancer à l’apoptose induite par les ligands de la mort, ce qui peut
représenter un fait important pour la lutte anti-cancéreuse.
Ghoneum M. (Université Ch. R. Drew, USA) : Cancer Letter (Lettres oncologiques), 2003
3.6. Activation de défense vitale
(a) L’effet actif du Biobran MGN-3 sur l’élimination des radicaux d’oxygène
Le rapport fait référence à la recherche de l’effet scavenger du produit Biobran MGN-3 et
deses fractions sur les radicaux d’oxygène. Le Biobran MGN-3 a été fractionné à l’aide de la
colonne Sephadex G-25. Les différentes fractions ont été marquées d’après leur taille par
les lettres L, M et S (L - poids moléculaire > 10000, M – poids moléculaire de 10000 à 3000,
et S – poids moléculaire < 3,000).
L’effet scavenger des enzymes actifs a été évalué par la mesure de cet effet sur l’anion
radical superoxyde (•O2), par la mesure de l’effet scavenger sur le radical hydroxyle
provenant de la réaction de Fenton (•OH), ainsi que par celle de l’effet scavenger sur le
radical hydroxyle généré par rayonnement ultraviolet.
Les résultats des mesures sont indiqués dans le tableau ci-dessous. Le meilleur résultat
d’inhibition de la création de radical hydroxyle •OH généré par •O2 et rayonnement
ulltraviolet a été obtenu par la fraction de Biobran marquée S (poids moléculaire le plus
bas). Toutes les fractions du produit ont fait preuve d’un grand effet scavenger sur
l’hydroxyle (•OH) généré par la réaction de Fenton. (Tableau n° 3)
Tableau n° 3
Effet scavenger du produit Biobran MGN-3 sur les radicaux oxygénés actifs
(•O2 et •OH et •OH induit par UV)
| Type d’oxygène actif et effet SOD |
Taux d’élimination de l’anion radical superoxyde (%) |
Effet SOD (superoxyde dismutase) (U/ml) |
Taux d’élimination du radical hydroxyle généré par UV (%) |
| 20 |
2.0
(mg/ml)
|
0.2 |
20 |
2.0
(mg/ml)
|
0.2 |
20 |
2.0
(mg/ml)
|
0.2 |
BioB
BioB-L
BioB-M
BioB-S
|
64.6
39.9
49.5
90.4
|
23.0
10.4
15.6
68.1
|
4.4
0
0
26.4
|
7.6
5.0
7.2
70.5
|
0.9
0.8
1.4
15.7
|
0
0
0
2.6
|
94.9
(72.6)
97.2
(41.8)
97.0
(45.4)
96.5
(71.0
|
78.9
(35.9)
34.4
(16.5)
68.4
(9.9)
55.1
(54.9)
|
3.3
(11.5)
3.3
(1.0)
8.7
(3.9)
4.2
(19.6)
|
·O2:HPX-par réaction XOD,·OH: par réaction de Fenton
·OH généré par réaction UV:365nm,4×103J/m2/min×5
Tazawa K. (Université de Médecine et de Pharmacie de Toyama, JAPON) : Biotherapy
(Biothérapie) Tôme 14, 2000
(b) Étude de base de l’influence du composé d’arabinoxylane (Biobran MGN-3) sur l’activation
de la défense vitale
Dans cette étude rapportant une expérience faite sur les animaux on a observé l’impact du
produit Biobran-MGN 3, son effet biophylatique sur le taux de survie après induction d’une
sepsie mortelle au lipopolysaccharide (LPS).
Pour l’expérience on a utilisé des souris de souche BALB/c (mâles âgés de 5-7 semaines).
Tous les deux jours pendant deux semaines, soit en tout sept fois, on a administré aux
souris par sonde 20 mg/kg, voire 200 mg/kg de produit Biobran MGN-3 dilué dans un tampon
phosphate salin (PBS) d’un volume de 0,5 ml. Les souris du groupe témoin ont obtenu 0,5 ml
de PBS par voie orale à des intervalles identiques. Douze heures après la prise de la
dernière dose orale, on a administré 200 µg LPS par voie intrapéritonéale dans le corps de
chaque individu de la population de souris puis on a observé l’état des individus. Dans une
autre expérience, on a administré 100 µg LPS dans le corps de chaque souris des deux groupes
– groupe de Biobran et groupe témoin – par voie intrapéritonéale ; les souris ont été
ensuite tuées par intervalles de 0, 2, 4 et 8 heures après l’administration du LPS et on
leur a fait un prélèvement de sang périphérique du coeur. Après la séparation du sérum on
a mesuré les valeurs de IL-6 et de TNF. L’activité du IL-6 a été mesurée en utilisant la
lignée cellulaire B9 et l’activité de TNF par test biologique sur les cellulairesde la
lignée WEHI164-13.
Comme l’on voit sur la Fig. 9, le taux de survie après l’administration de 200 µg de
LPS,comparativement au groupe témoin, était bien meilleur dans les groupes d’individus
auxquels on avait donné quotidiennement 20 mg/kg et 200 mg/kg de produit Biobran MGN-3
(groupe Biobran MGN-3 20mg/kg contre groupe témoin, p = 0,0456; groupe Biobran MGN-3 200
mg/kg contre groupe témoin, p = 0,0232, analyse par test de Mantel-Cox). Après
l’administration de 100 µg LPS par individu des groupes auxquels on avait administré du
Biobran MGN-3 chaque jour à raison de doses de 20 mg/kg et 200 mg/kg, toutes les souris ont
survécu alors que, dans le groupe témoin, 3 sur 10 individus sont morts.
Afin de dévoiler le mécanisme qui explique le taux d’amélioration de la survie dans le
groupe de Biobran MGN-3 on a mesuré la concentration de IL-6 et TNF dans le sang. Dans le
groupe auquel on avait administré du Biobran MGN-3, la concentration de IL-6 dans le sang au
bout de deux heures après l’administration du Biobran MGN-3 était beaucoup plus faible que
dans le groupe témoin (groupe témoin 702,9 ± 24,7 ng/ml, groupe Biobran MGN-3 403,1 ± 59,6
ng/ml; p < 0.01), mais 8 heures après l’administration a augmenté nettement (groupe témoin
88,5 ± 50,0 ng/ml, groupe Biobran MGN-3 441,0 ± 115,0 ng/ml ; p < 0.05). La concentration de
TNF dans le sang a augmenté de manière importante 4 heures après l’administration du LPS
dans le groupe Biobran MGN-3 comparativement au groupe témoin (groupe témoin 492 ± 187,
groupe Biobran MGN-3 1816 ± 307 pg/ml; p < 0.01).
Dans le modèle expérimental de sepsie mortelle induite par le LPS on a supposé qu’une grande
partie des cytokines pro-inflammatoires (IL-1, 6, TNF-α) libérés des cellules du système
réticulo-endothélial dans tout l’organisme causait la défaillance de nombreux organes
provoquant ainsi la mort. Dans cette étude cependant, dans le groupe auquel on a administré
du Biobran MGN-3, on a observé une augmentation importante du taux de survie. Ceci
s’explique peut-être par le fait que le produit Biobran MGN-3 inhibe la création de
cytokines histotoxiques produites par les macrophages ou ou encore que le Biobran MGN-3
bloque la voie à l’histotoxicité au niveau des cellules-cibles.
Sudo N., Kubo C. (Université de Kyushu, JAPON) : The Japanese Journal of Clinical and
Experimental Medicine (Journal japonais de la médecine expérimentale et clinique), Tôme 78,
1, 2001
(c) Réduction de la masse corporelle chez les souris après l’administration de Cisplatine
grâce au Biobran MGN-3.
Dans le traitement du cancer, les médicaments contenant du platine provoquent souvent de
graves effets secondaires tels que les nausées, les vomissements, la néphropathie et
l’hypomagnésie, causés par l’endommagement des tubules rénaux (Lajer & Dangaard 1999), tels
que également la perte de l’ouïe, la neuropathie périphérique et la myélosuppression qui est
l’un des effets secondaires les plus dévastateurs (Prestayko et coll. 1979) qui conduit à
l’affaiblissement de l’immunité.Toute possibilité d’empêchement du développement des effets
secondaires du cisplatine est donc la bienvenue et fortement appréciée. Nous nous sommes
efforcés d’examiner l’impact du Biobran MGN-3 sur la réduction de la perte de poids chez les
souris auxquelles on a administré la dose maximale tolérable de cisplatine.
Une semaine avant l’administration de cisplatine nous avons commencé celle de Biobran MGN-3
aux souris des deux groupes, et à raison de doses de 10 mg/ml (matière sèche) dans l’eau,
voire par injection intrapéritonéale de 0,1 ml dans laquelle une dose équivalente de produit
a été diluée dans un tampon salin (PBS). La dose de 1 mg par individu a été calculée
à partir de la dose humaine recommandée (50 mg/kg). Le cisplatine d’une quantité de 15 mg/kg
a été administré par voie intrapéritonéale dans 0,1 ml de tampon salin (PBS) contenant 0,5 %
d’acide dimercaptosuccinique(DMSO) comme porteur. On a administré de l’eau par sonde, voire
du PBS par voie intrapéritonéale aux deux groupes de souris et, une semaine après, du
cisplatine également aux deux groupes.
Une réduction de poids a été enregistrée dès le lendemain de l’administration par injection
péritonéale du cisplatine sur les deux groupes, que ce soit le groupe avec Biobran MGN-3 ou
celui sans Biobran MGN-3. La plus grosse perte a été notée le 5e jour après l’administration
du cisplatinedans les deux groupes, que ce soit avec ou sans Biobran, que le produit ait été
administré oralement ou par voie intrapéritonéale. La perte la plus importante de poids
a été notée chez les souris qui ont obtenu le cisplatine sans le produit Biobran MGN-3. Bien
que la perte de poids chez les souris auxquelles le Biobran MGN-3 a été administré
s’approchait des 20% observés chez les souris des groupes ayant obtenu du cisplatine sans
Biobran MGN-3, il y a lieu de constater qu’aucune souris n’est morte dans ce groupe,
qu’aucune d’entre elles n’a eu de diarrhée ou de sang dans les excréments – effets
secondaires habituels de l’administration du cisplatine. Dans laphase de convalescence,
comparativement aux groupes sans Biobran MGN-3, les souris des groupes au Biobran ont repris
du poids plus rapidement.
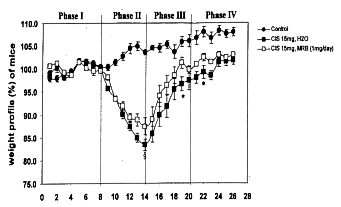 Fig. 10 Légende : profil du poids des souris (en %)
Fig. 10 Légende : profil du poids des souris (en %)
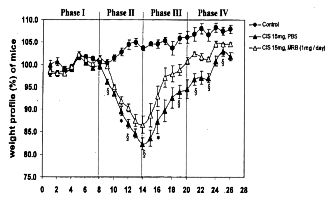 Fig. 11
Fig. 11
Endo Y., Kanbayashi H. (UniversitéMac Master, CANADA) : Pharmacology and Toxicology
(Pharmacologie et toxicologie), 2003
(d) Influence du produit Biobran MGN-3 sur la toxicité induite par cisplatine et adriamycine
chez les rats
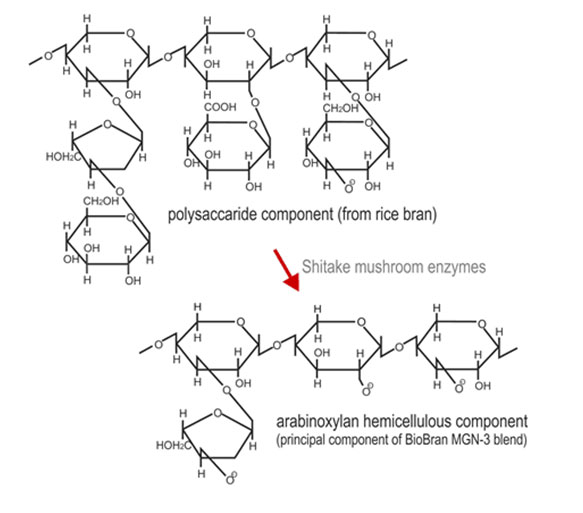
Le Biobran MGN-3 est un dérivé du son de riz fabriqué par hydrolyse partielle de fractions
de fibre de riz solubles dans l’eau par carbohydrases du champignon lentinus edodes [Brevet
USAn°5560914]. Il a été démontré que le Biobran MGN-3 est un modificateur de réponse
biologique provoquant chez les patients à l’immunité affaiblie une augmentation de
l’activité des cellules NK [Int. J. Immunother. 14 (1) 1998].
Objectif: par l’administration quotidienne de Biobran MGN-3 à raison de 5,
voire 50 mg/kg, prévenir les changements pathologiques graves et la perte de poids liés à
l’administration d’une seule dose de cisplatine (CIS), voire d’adriamycine (ADR). Après 13
jours d’acclimatation, on a choisi des rats mâles de souche Spaque-Dawley d’après leur poids
puis on les a répartis en huit groupes de 10 individus (doses indiquées en mg/ml):
-
Biobran 5 mg p.o.+porteur i.p.
-
Biobran 50 mg p.o.+porteuri.p.
-
Groupe témoin p.o.+CIS 8mg i.p.
-
Biobran 5 mg p.o.+ CIS 8mg i.p.
-
Biobran 50 mg p.o.+ CIS 8mg i.p.
-
Groupe témoin p.o.+ADR 10mg i.p.
-
Biobran 5 mg p.o.+ ADR 10mg i.p.
-
Biobran 50 mg p.o.+ ADR 10mg i.p.
On a administré aux rats par voie orale (p.o.) du produit MGN-3 (dilué dans de l’eau
distillée) et le porteur pendant 11 jours, quotidiennement. Chaque individu testé a obtenu
le produit chimiothérapeutique ou porteur en une seule injection intrapéritonéale (i.p.) le
3e jour. Durant tous les 11 jours, chaque jour, on a suivi les symptômes cliniques sur les
rats. Leur poids a été mesuré tous les deux jours. Le 11e jour les animaux ont été
euthanasiés par inhalation de CO2 puis autopsiés. Les organes principaux ont été vérifiés et
les dommages subis par l’appareil gastro-intestinal ont été notés.
Résultats: Entre le 7e et le 11e jour cinq rats du 3e groupe, trois du 5e
et un du 4e sont morts. Les rats auxquels on avait administré uniquement du Biobran MGN-3 à
raison de doses de 5 ou 50 mg/kg p.o. ont été marqués par une hausse importante de leur
poids (+72%). Les rats auxquels on n’avait administré que du CIS ou de l’ADR ont enregistré
une petite augmentation de poids (-1,5% chez le groupe CIS et +30% chez le groupe ADR). Les
rats ayant obtenu 5 ou 50 mg de Biobran MGN-3 plus CIS ou ADR ont montré une prise de poids
bien plus importante que les rats n’ayant obtenu que du produit chimiothérapeutique (+11%
chez le groupe Biobran MGN-3 5 mg + CIS et +46% chez le groupe + ADR). Dans le groupe
Biobran MGN-3 50 mg + CIS la hausse de poids a été de +44%,et dans le groupe Biobran MGN-350
mg + ADR +43%. Comparativement au groupe de rats qui n’ont obtenu que du CIS ou de l’ADR
sans Biobran MGN-3, les rats survivants auxquels on avait administré du Biobran MGN-3
semblaient plus sains, prenaient du poids et on a aussi enregistré une apparition moindre de
pathologies intestinales graves.
Tableau n° 4: Effet du produit Biobran sur la perte de poids corporel
induite par le cisplatine et la doxorubicine
| Thérapie (par voie intrapéritonéale dans tous les cas) |
Jour 0 |
Jour 3 |
Jour 5 |
Jour 7 |
Jour 9 |
Jour 11 |
5mg/kg p.o.+porteur
50mg/kg p.o.+ porteur
Groupe témoin p.o.+Cp8mg/kg
5mg/kg p.o.+Cp8mg/kg
50mg/kg p.o.+Cp8mg/kg
Groupe témoin p.o.+Dx10mg/kg
5mgn/kg p.o.+Dx10mg/kg
|
100
100
103
99
101
103
101
101
|
100
98
101
99
99
100
100
101
|
100
100
82
85
92
88
92
92
|
100
97
69
76
90
82
89
87
|
100
97
55
68
85
77
86
85
|
100
97
57
65
84
76
85
83 |
p.o.-par voie orale, Dx-doxorubicine, Cp-cisplatine
Jacoby H. I. (USA) : Journal of Nuturaceuticals, Function & Medical Foods (Journal de
nutraceutiques et aliments fonctionnels), tôme 3 (4) 2001
(e) Effet du Biobran MGN-3 sur la toxicité induite par radiothérapie chez les souris
Cette étude avait pour objectif d’observer l’effet modificateur du produit Biobran MGN-3 sur
la radiosensibilité se manifestant par une diminution de la moëlle osseuse causée par le
rayonnement global de l’organisme. Dans la perspective de l’éventuelle applicabilité en
milieu clinique, les auteurs ont testé les effets du point de vue quantitatif à travers tout
le spectre des doses de rayonnements de 4,5 à 8,5 Gy.
Pour les expériences on a utilisé des souris mâles âgées de 4 et 5 semaines de souche SPF
BALB/c (groupeF2). Dans des groupes choisis, on a ajouté du Biobran MGN-3 à raison de 50 mg
par kilogramme de masse corporelle à l’alimentation des souris. Les groupes étaient composés
de 10 à 50 individus. Après deux jours d’acclimatation, on a ajouté du Biobran MGN-3 à
l’alimentation des souris du groupe testé (F2). Au bout de 8 et 15 jours d’administration du
Biobran MGN-3, les individus ont été soumis aux rayonnements. On a ensuite mesuré trois fois
par semaine leur poids et chaque jour on a suivi la mortalité. Dans certains cas le Biobran
MGN-3 a été administré deux semaines entières avant les rayonnements, dans d’autres
l’administration du produit a été réalisée après les rayonnements.
Tandis que dans le groupe F2 les souris ont commencé à mourir en conséquence de la perte de
moëlle osseuse dès le septième jour suivant les rayonnements, les souris des groupes
auxquels le Biobran MGN-3 avait été additionné avaient tendance à périr un peu plus tard. La
dose de LD50 (causant la mort d’au moins la moitié des animaux irradiés) était d’environ
5,15 Gy, sachant que le facteur de réduction de dose (DRF) était d’environ 1,14. S’agissant
de la masse corporelle, dans les groupes Biobran MGN-3 on a observé une tendance au maintien
du poids. Le début plus précoce de l’effet avec administration du produit Biobran MGN-3
indique qu’il vaut mieux commencer l’utilisation du produit avant le rayonnement.
La dose de rayonnement des souris au milieu de l’organisme a été calculée comme étant 1,21
fois plus élevée que les doses indiquées ci-dessus, ce qui signifie que la dose de LD50 chez
les individus du groupe de contrôle était 6,23 Gy. Bien que l’effet radioprotecteur (DRF) du
Biobran (qui était de 1,14) n’était pas très élevé, il convient d’ajouter que dans le cadre
de toute cette étude aucun effet secondaire n’a été noté.
Nakatugawa S. (Université de Nagoya, JAPON) : The Report of Nagoya Univ. (Rapport de
l’Université de Nagoya), 2003
(f) Effet du produit Biobran MGN-3 sur le dysdonctionnement du foie provoqué de manière
expérimental chez les rats
Dans l’étude présente on a examiné l’effet du produit Biobran MGN-3 sur le dysfonctionnement
du foie, concrètement sur le développement du dysfonctionnement du foie provoqué de manière
expérimentale suite à l’administration de galactosamine (GaIN) et d’acétaminophène (AAP). La
GaIN a été administrée dans les expériences n°1 à 3 et l’AAP dans les expériences n°4 et 5.
Dans l’expérience n°1, par voie intrapéritonéale, du produit Biobran MGN-3 a été administré
aux rats sous différentes concentrations, puis une heure après on leur a injecté du GaIN à
raison de 800 mg/kg.
Dans l’expérience n°2, par voie orale, on a administré du Biobran MGN-3 non fractionné et,
par voie intrapéritonéale, fractionné de poids moléculaire haut et bas.
Dans l’expérience n°3, par voie intrapéritonéale, du Biobran MGN-3 a été administré après
avoir été réchauffé, hydrolysé et filtré par résine échangeuse d’ions. Une heure après on
a injecté du GaIN à raison de 800 mg/kg.
Dans l’expérience n°4, par voies intrapéritonéale et orale, on a administré du Biobran MGN-3
et une heure après on a injecté de l’AAP à raison de 700 mg/kg dans les organismes des rats.
Dans l’expérience n°5, par voie intrapéritonéale, du Biobran MGN-3 a été administré après
avoir été réchauffé, hydrolysé et filtré par résine échangeuse d’ions. Une heure après on
a injecté de l’AAP à raison de 500 mg/kg.
Dans toutes les expériences les animaux ont été euthanasiés 24 heures après les injections
de GaIN et d’AAP et on a déterminé les valeurs de transaminase sérique (GOT, GPT).
Résultats
Expérience n°1: dans tous les groupes où l’on a administré le Biobran
MGN-3, on a constaté que l’activité des GOT et GPT sériques provoquée par le
dysfonctionnement du foie induit par la GaIN était très inhibée, comparativement à
l’activité mesurée sur le groupe témoin. L’effet suppresseur du produit Biobran MGN-3 sur le
dysfonctionnement du foie induit par la GaIN a atteint son summum à la dose de 20 mg/kget
n’a plus augmenté avec l’utilisation de doses supérieures de Biobran MGN-3.
Expérience n°2: dans tous les groupes où l’on a administré le Biobran
MGN-3, fractionné et non fractionné, que le poids moléculaire ait été plus élevé ou plus
bas, on a assisté à une forte inhibition de l’augmentation de l’activité de la GPT sérique
suite au dysfonctionnement du foie induit par la GaIN comparativement aux augmentations
enregistrées dans le groupe témoin. Les effets suppresseurs du produit Biobran MGN-3
fractionné et non fractionné étaient similaires.
Expérience n°3: dans les groupes où on a administré du Biobran MGN-3
hydrolysé, on a assisté à une forte inhibition de l’augmentation de l’activité de la GOT
sérique suite au dysfonctionnement du foie induit par la GaIN comparativement aux
augmentations enregistrées dans le groupe témoin.
Expérience n°4 : dans les groupes où on a administré du Biobran MGN-3 par
voies intrapéritonéale et orale, on a assisté à une forte inhibition de l’augmentation de
l’activité de la GOT sérique suite au dysfonctionnement du foie induit par l’AAP
comparativement aux augmentations enregistrées dans le groupe témoin.
Expérience n°5: des résultats semblables à ceux de l’expérience n°3 ont été
obtenus avec le Biobran MGN-3 hydrolysé y compris après l’administration de l’AAP. Dans les
groupes où on a administré du Biobran MGN-3 hydrolysé, on a assisté à une forte inhibition
de l’augmentation de l’activité de la GOT sérique comparativement aux augmentations
enregistrées dans le groupe témoin.
Ces expériences ont confirmé que le Biobran MGN-3 possédait des effets suppresseurs sur le
dysfonctionnement du foie induit par la GaIN et l’AAP. La composante active HCI du produit,
semble-t-il, n’hydrolyse pas.
Yamada T. (Université de Chiba, JAPON): Résumé de la 6e rencontre annuelle de l’Association
japonaise de recherche sur la fibre alimentaire, 2002
(g) L’utilisation orale du produit Biobran MGN-3 réduit le syndrôme de rhume chez les
personnes âgées
Chez les groupes à haut risque tels que les personnes âgées et les enfants, il est important
de veiller aux mesures de prévention anti-infectieuses telles que la vaccination contre la
grippe et surtout les mesures qui peuvent empêcher le développement d’infections
bactériennes secondaires. Lors de l’étude, du point de vue de l’âge, de cas de pneumonies
contractées dans le milieu qui se sont développées à partir d’une dégradation d’un rhume
courant, on s’est rendu compte que le risque d’infection bactérienne secondaire était plus
élevé chez les personnes âgées de plus de 75 ans. Le risque d’inflammation pulmonaire
concomitante est également supérieur chez les patients âgés atteints de maladies
neurologiques chez lesquels il y a un haut risque d’aspiration. C’est pourquoi notre
recherche a été consacrée à l’apport clinique du produit Biobran MGN-3 en matière de
prévention contre le développement du rhume courant chez les personnes âgées où la capacité
de réaction immunitaire est réduite à cause de divers facteurs.
Parmi les clients soignés au centre médical „Atreyu Uozaki“ de Kobé, préfecture de Hyógó, un
groupe de clients plus âgés qui ne souffraient d’aucune maladie grave et étaient d’accord
pour participer à l’étude, a été choisi dans la période de janvier à mars 2002. On a testé
le complément alimentaire, la fraction du produit Biobran MGN-3 (HRB), et dans le groupe
témoin on a utilisé de la fibre de riz comprenant notamment des parties solubles dans l’eau
(RB).
S’agissant des symptômes du rhume (fièvre, mal de tête, fatigue, tremblement, toux, glaires,
écoulement du nez, nez bouché, mal de gorge, douleur de poitrine), on a calculé le nombre de
jours durant lesquels on a observé ne serait-ce qu’un seul d’entre eux. Chaque symptôme
a été évalué d’une note en fonction de son intensité (aucune manifestation = 0,
manifestation faible = 1, moyenne = 2, forte = 3) puis, en faisant la division de la note
totale de chacun des patients par le nombre de jours de prise de la substance testée, on
a calculé son „score symptomatique de rhume“.
Résultats: parmi les différents symptômes, au début du traitement, la
„toux“, la „fatigue“, et le „mal de gorge“ se manifestaient fortement. Dans le groupe HRB,
le nombre total de jours pendant lesquels les symptômes se sont manifestés était,
contrairement au groupe RB, plus petit. Dans le groupe RB, on a enregistré au total un score
symptomatique de rhume plus élevé. Et bien que,dans le groupe RB, le score des „symtômes du
nez“ était plus bas, celui des symptômes courants tels que „toux“, „fatigue“ et „fièvre“
était plus haut. On a donc tiré la conclusion que les symptômes de rhume courant étaient
moins importants dans le groupe HRB.
L’étude a montré que lors de l’administration du HRB par voie orale chez les patients âgés
souffrant de rhume courant, la durée de la manifestation des symptômes était plus réduite
grâce à l’effet immunostimulant de l’extrait, les symptômes n’empiraient pas et il n’y avait
donc pas autant besoin de traitement symptomatique.
Tazawa K. (Université de Pharmacie et de Médecine de Toyama, JAPON) : Journal de médecine
traditionnelle, 20 (3), 2003
3.7. Effet anti-allergique
(a) Évaluation de l’effet préventif du produit Biobran Biobran MGN-3 et réduction des
symptômes de l’asthme dans le modèle asthmatique murin
Dans cette étude, on a suivi l’effet préventif du Biobran MGN-3 et la réduction des
symptômes de l’asthme sur le modèle murind’asthme induit par le diisocyanate de
toluène(TDI).
On a d’abord préparé une solution d’eau potable et de Biobran MGN-3 de concentration de 2
g/litre que l’on a administré aux souris (femellles de souche BALB/c), divisées en 4 groupes
(A-D):
Groupe A: le Biobran MGN-3 a été administré un mois avant, puis pendant la
phase de sensibilisation au TDI et dans la période suivante.
Groupe B: le Biobran MGN-3 a été administré un mois avant, puis jusqu’à la
fin de la phase de sensibilisation au TDI.
Groupe C: le Biobran MGN-3 n‘a été administré que pendant la période de
sensibilisation au TDI.
Groupe D: groupe témoin.
Dans le groupe B on a évalué l’effet préventif et dans le groupe C l’effet de réduction des
symptômes. L’effet du produit Biobran a été mesuré d’après les concentrations d’histamine
dans le sang, le nombre d’éosinophiles dans le liquide de lavage broncho-alvéolaire (BALF),
d’après le test d’application de TDI du pavillon auriculaire ainsi que d’après les valeurs
d’antigènes selon les types spécifiques IgG1, IgG2a, IgEdans le sang pendant la
sensibilisation.
Les plus fortes concentrations d’histamine dans le sang ont été mesurées 7 minutes après
l’application de TDI comme suit : groupe A: 2.5±0.53, groupe B: 4.2±0.75, groupe C: 4.3±7.8,
groupe D: 6.4±0.87 (ng/ml), autrement dit des valeurs nettement plus basses ont été
enregistrées, par rapport au groupe témoin, là où le Biobran MGN-3 a été administré. Lors du
test de la sensibilisation à diverses concentrations TDI (de 0,01à 10%) a assisté chez les
groupes auxquels le Biobran MGN-3 a été administré, à une baisse jusqu’à 10-100 fois
supérieure de la sensibilité par rapport au groupe de témoin. Par ailleurs, dans les groupes
Biobran MGN-3, on a constaté des quantités nettement inférieures d’éosinophiles dans le BALF
et aussi des valeurs plus réduites dans le test d’application de TDI. En revanche, aucune
différence marquée entre les différents groupes n’a été notée en ce qui concerne les valeurs
des antigènes dans le sang.
On en conclut que l’administration du produit Biobran MGN-3 agit de manière prouvée
préventivement et réduit les symptômes de l’asthme sur le modèle murin d’asthme induit par
le diisocyanate de toluène (TDI). L’étude indique également que le Biobran MGN-3 n’influe
pas sur la création d’antigènes de type IgG1 ou IgE, induite par Th2, et que le produit
fonctionne comme un facteur suppresseur vis-à-vis des mastocytes.
Kobayashi H., Endo Y. (Université Mc Master, CANADA) : Résumé de la 52e rencontre annuelle
de la Société japonaise des allergologues, 2002
(b) Effet inhibiteur du produit Biobran MGN-3 sur la progression de la dermatite atopique
chez les souris NC
Dans cette étude on a examiné l’effet immuno-régulateur du produit Biobran MGN-3 sur les
souris NC chez lesquelles le niveau plus élevé de IgE dans le sérum évolue naturellement et
des lésions de peau semblables à la dermatite se développent en réaction à la
sensibilisation par ovalbumine (OVA). Le Biobran MGN-3 a été administré par voie orale à
cinq souris NC qui ont été ensuite comparées avec le groupe témoin sans Biobran MGN-3. Les
souris ont été ensuite sensibilisées à l’ovalbumine. Des échantillons sanguins ont été
prélevés deux semaines avant et deux semaines après la sensibilisation. Les quantités
totales d’IgE, y compris d’IgE spécifique de l’OVA dans les sérums, établies par le test
ELISA ont été beaucoup plus basses chez les souris traitées au Biobran MGN-3 que chez les
individus de groupe témoin. À part cela, tandis que chez les individus NC qui n’avaient pas
reçu du Biobran MGN-3, des lésions dermales similaires à la dermatite atopique se sont
développées, ces lésions ne sont pas apparues chez les cinq souris sur cinq traitées au
produit Biobran MGN-3. On en conclut que le Biobran MGN-3 inhibe la progression de la
dermatite atopique chez les souris NC.
Nonoyama S. (Université de médecine et stomatologie deTokio, JAPON) : Résumé de la 11e
rencontre annuelle du Congrès international des immunologues, 2001
© Droits d‘auteur 2003: Hiroaki Maeda / Daiwa Pharmaceutical
(Remerciements pour l’autorisation de publier cet article sur le site Biobran.org.)
 Le chef des recherches sur
leproduit Biobran est le Dr. Mamdooh Ghoneum, professeur à la Chaire d’immunologie de
l’Université de Médecine et de Sciences naturelles Charles R. Drew aux États-Unis. Le
Dr. Ghoneum, actuellement reconnu au niveau international dans le domaine de l’approche
immunothérapeutique du traitement oncologique, a obtenu le titre PhD. en
radio-immunologie à l’Université de Tokio et consacre depuis son travail à l’immunologie
à l’Université californienne de Los Angeles. Il s’est employé pendant les 20 dernières
années à étudier diverses substances capables d’améliorer le fonctionnement du système
immunitaire et selon lui le Biobran MGN-3 est le complexe immunitaire le plus puissant
qu’il ait jamais testé. Les résultats l’ont ahuri à tel point qu’à l’heure actuelle il
consacre toute son attention scientifique au traitement à l’aide de ce composé.
Le chef des recherches sur
leproduit Biobran est le Dr. Mamdooh Ghoneum, professeur à la Chaire d’immunologie de
l’Université de Médecine et de Sciences naturelles Charles R. Drew aux États-Unis. Le
Dr. Ghoneum, actuellement reconnu au niveau international dans le domaine de l’approche
immunothérapeutique du traitement oncologique, a obtenu le titre PhD. en
radio-immunologie à l’Université de Tokio et consacre depuis son travail à l’immunologie
à l’Université californienne de Los Angeles. Il s’est employé pendant les 20 dernières
années à étudier diverses substances capables d’améliorer le fonctionnement du système
immunitaire et selon lui le Biobran MGN-3 est le complexe immunitaire le plus puissant
qu’il ait jamais testé. Les résultats l’ont ahuri à tel point qu’à l’heure actuelle il
consacre toute son attention scientifique au traitement à l’aide de ce composé.



 Figure 5: Taux de formation des liaisons entre les cellules naturelles
tueuses (cellules NK) et les cellules-cibles K562. Légende : % de liaisons>Avant
utilisation>Après utilisation
Figure 5: Taux de formation des liaisons entre les cellules naturelles
tueuses (cellules NK) et les cellules-cibles K562. Légende : % de liaisons>Avant
utilisation>Après utilisation
 Fig 6: Formations mortelles de cellules NK et de cellules–cibles
cancéreuses.
Fig 6: Formations mortelles de cellules NK et de cellules–cibles
cancéreuses.
 Figure 7: Matsuura M. (École de Médecine de Djitshi, JAPON) : Rapport de
l’École de Médecine de Djitshi
Figure 7: Matsuura M. (École de Médecine de Djitshi, JAPON) : Rapport de
l’École de Médecine de Djitshi

 Fig. 10 Légende : profil du poids des souris (en %)
Fig. 10 Légende : profil du poids des souris (en %)
 Fig. 11
Fig. 11